更多文章
更多精彩文章

结构
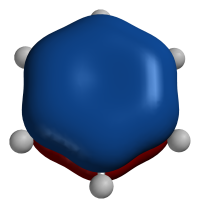
苯的π轨道呈环状,但中心仍有电子分布
π轨道是一种由轨道并肩重叠后所形成的分子轨道,除了s轨道无法形成π轨道,之外,大部分的轨道都可以形成π轨道,较常是由两个p z 轨道所形成,但实际上只要方向对了,无论是p x 或p y 都能形成π轨道。
π轨道可以有很多形状,但都不与核轴成旋转对称,其形状取决于他所形成的π键,例如:有共振时,π轨道就会变得较大较狭长,若是环状的共振,则其π轨道呈环形。其能容纳的电子数量也由其所形成的π键来决定,如乙烯内所形成的π轨道可容纳下2个电子,而苯的π轨道呈环状,可容下6个电子,这是因为共振使电子均匀分布而导致。
此外,在形成化学建的过程中,未杂化的轨愈有可能形成π轨道,如乙烯,碳上形成了sp 杂化轨道,而未杂化的p轨道则形成π轨道。
轨道能级
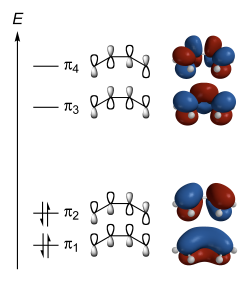
丁二烯中,不同能级的π轨道及其形状。
根据休克尔方法,可得出不同能量的π轨道,不同能级的π轨道形状不尽相同,电子会先从能量低的π轨道开始填入,例如丁二烯 ,其不同能级π轨道能量如下:
其电子会先从π 1 轨道开始填入,然后才填π 2 轨道,根原子轨道一样,一种形状只能填2个电子,且自旋互为相反数,因此整个π轨道,π 3 轨道和π 4 轨道两个能级是空的,但要注意:此处的能级(繁体:能級)并非是电子壳层的能级(繁体:能階)。
π*轨道
π*轨道是π轨道的反键轨道,当核间轴发生旋转时会产生相位的变化。π*轨道类似于σ*轨道,在原子核之间也有一个波节。
π键
参见
s轨道
p轨道
d轨道
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。













{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}